氢键


大家好,今天给大家简单介绍一下氢键。

氢键是一种很特殊的分子间作用力。在地球上的水分子之间,正因为有了氢键的存在,才形成了如此晶莹剔透而又形态万千的雪花。

在冰的结构中,五个水分子靠氢键作用,形成了以四个氧原子为顶点的正四面体结构单元。

这种结构使冰晶呈现六方堆积,因此雪花才会是六角形的。

水分子间的强氢键作用不仅决定了冰的结构形态,而且也影响了水在不同温度时的聚集状态。

这种影响不仅存在于水这样的无机物中,在有机物中也同样如此。譬如,有机物的沸点变化规律与氢键总是息息相关。而且,在各种大分子参与的生命现象中,氢键更起着至关重要的作用,比如DNA的双螺旋结构。

再比如,棉纤维素中的纤维细丝也是由多糖碳链靠氢键连接而成。因此,在我们系统学习有机物之前,必须先来了解一下氢键的定义以及氢键的类型。
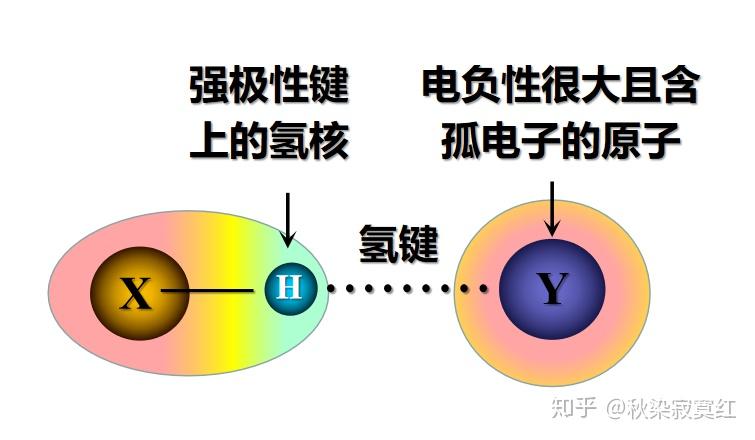
氢键是指强极性键上的氢,与电负性很大、含孤对电子的 并带有部分负电荷的原子之间的吸引力作用。氢键为区别化学键,用虚线表示。其中,强极性键上的氢是氢键供体,给出的是缺少电子的近似于裸露的氢核,而原子Y是氢键的受体,可以是富有电子的分子、离子或分子片段。
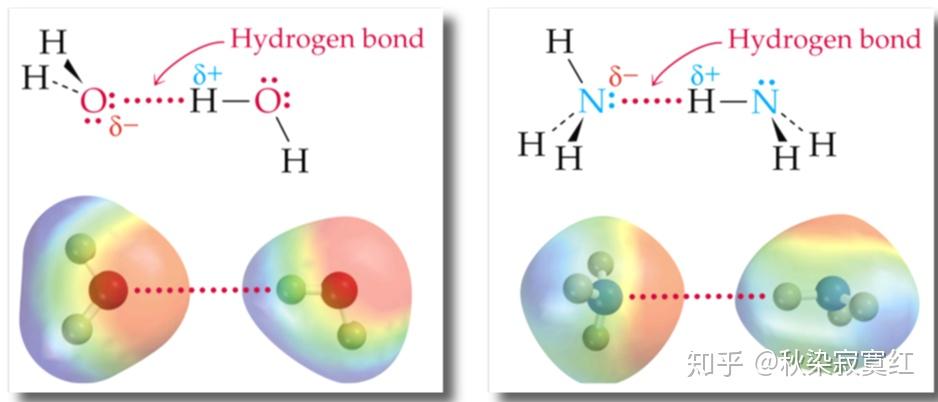
从定义中,我们能够看出,氢键的强弱取决于构成氢键的、除氢以外的另两原子的电负性,这二者的电负性越强,则氢键越强。在初等有机化学的学习中,我们一般只把作用很强的氢键视为典型氢键,不考虑那些弱作用的氢键。

因此,形成典型氢键的必要条件,就应该有如下两点:首先形成氢键的结构中要有 与电负性很大的氮、氧、氟相连的氢原子,该氢原子上的电子绝大部分偏向于电负性较大的氮氧氟,自己近乎于裸露,带有部分正电荷,可以亲近富有电子的受体。而作为受体的一方,仅仅富有电子并不足够,还需要有很大的电负性,且能提供孤对电子,能俘获氢核,并可在一定限度内紧抓不放,这样氢键的作用才会相对稳定。
通常满足这个条件的氢键受体,只有三种原子,即氮氧氟原子,它们的原子半径足够小,电负性足够大,且能提供孤对电子。

由于氮氧氟孤对电子所占轨道具有方向性,因此,氢键也是有方向性的。

其实,狭义的典型氢键无非是氮氧氟上连有的氢与其他结构中的氮氧氟三种原子间的相互作用力。在我们初等有机化学中所涉及的氢键类型,仅仅是它们几个随机排列出的九种组合。

氢键中氢的两侧,有且仅有氮氧氟三种原子。氢与氮氧氟原子连接所造成的电子亏损,一旦有机会,就要从其他氮氧氟原子中寻求部分的补偿,这样才会让氢原子微观世界里获得“失未尽失,得未尽得”的平衡。
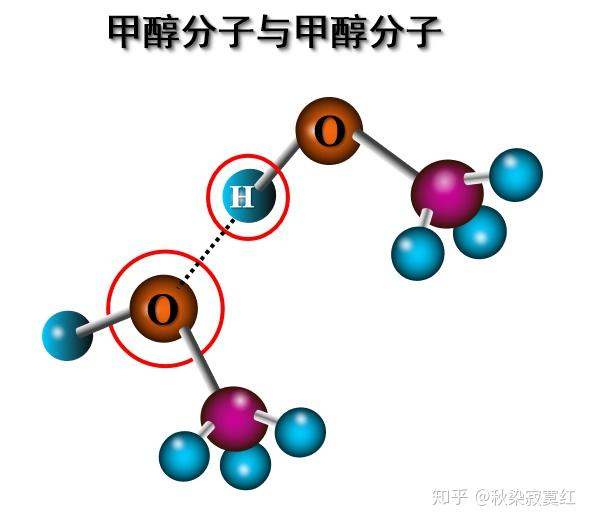
同种物质的分子间和不同种物质的分子间都可以形成氢键,只要满足形成氢键的两个条件。甲醇分子间可以形成氢键,一分子提供与O相连的氢核,一分子提供接受氢核的O。

乙醚分子间则不能形成氢键,虽然有电负性很大的O原子,却没有与氮氧氟相连的近乎于裸露的H核。
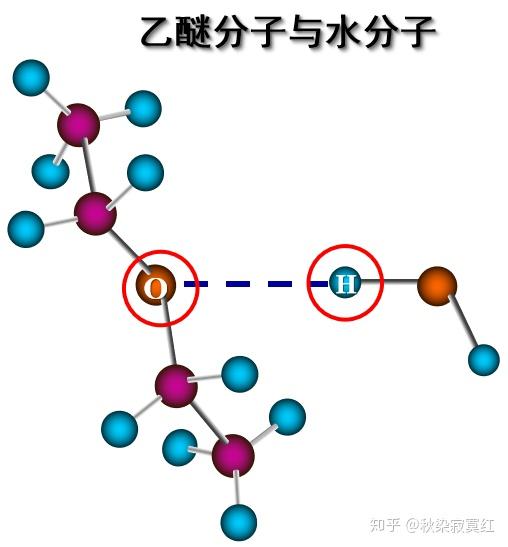
但乙醚分子可以与水分子形成氢键,因为水分子提供了与O相连的H核。

氢键的能量约在10~30kJ·mol-1,比共价键、离子键的能量都小得多,还不能算作严格意义上的化学键,但比一般分子间作用力要大。

因此,液体在沸腾时,分子要逃脱氢键的束缚,就需要升高温度以吸收更多的能量,这就是分子间氢键的存在造成液体沸点升高的根本原因。
关于氢键的介绍,就到这里,再见。
