无机化学篇——P区元素
P.S. :以区域划分,S区元素及其性质在⬇
1.P区元素概述
1.同一主族元素从上至下金属性逐渐增强 ns^2np^a 各族元素会呈现出二次周期性:
(1)第二周期元素有反常性(因为只有2s和2p轨道):形成配合物时,配位数最多不超过4;第二周期元素单键键能小于第三周期元素单键键能。P.S:电子亲合能最大的是Cl(F的半径太小了)
(2)第四周期元素表现出异样性:溴酸、高溴酸氧化性分别比其他卤酸、高卤酸强。(比较氧化性可以通过比较电极电势来比较##成正比)。
(3)同一主族,最后三种元素缓慢递变。(如原子半径)
2.P区元素具有多种氧化值。
惰性电子对效应:同族元素从上到下,低氧化值化合物比高氧化值化合物更稳定。(因为越往下,ns轨道上的电子越不容易参加反应,具有一定的惰性)
可以用惰性电子对效应解释P区元素的氧化性大。
3.P区元素电负性大,倾向于形成共价型的化合物。
4.P区元素是唯一一个包含金属和非金属元素的一个区,是无机非金属材料库。
2.硼族元素
2.1.硼族元素的概述
价电子构型: ns^2np^1 ;缺电子原子:价电子数<价层轨道数; 缺电子化合物:成键电子对数<夹层轨道数。(缺电子原子形成的化合物为缺电子化合物)。 注: \ce{HBF4} 不是缺电子化合物。
缺电子化合物的特点:1.易形成配位化合物HF \rightarrow\ce{BF3} ;2.易形成双聚物 \ce{Al2Cl6} (中间的两个氯原子垂直于平面)。

2.2.硼单质及其性质
在硼族元素形成配合物时,B的最大配位数是4,其他的最大配位数为6。

有关硼单质的同素异形体:无定形硼&晶型硼(α-菱形硼, \ce{B12} ——正20面体,12个硼)
2.3.硼的化合物
1.硼的氢化物:硼烷从乙硼烷开始 \ce{B2H6} 。(乙硼烷结构如下图)
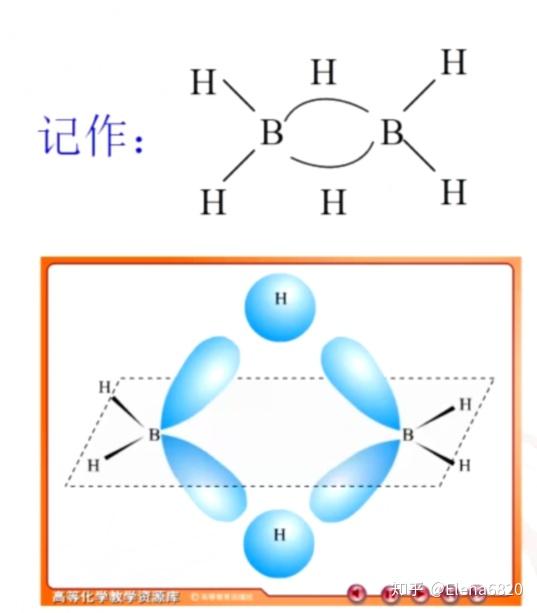

乙硼烷结构:利用 sp^3 杂化轨道,与氢原子形成三中心两电子键(氢桥)
乙硼烷的性质:(是高能燃料,有剧毒)
(1)自燃: \ce{B2H6 + 3O2 \rightarrow B2O3 + 3H2O} (含硼化合物燃烧时火焰呈绿色)
(2)水解: \ce{B2H6 + 3H2O\rightarrow 2H3BO3 + 6H2} (放热生成硼酸和氢气,可以用作水下火箭的燃料)
(3)加合: \ce{B2H6 + 2CO \rightarrow 2[H3B\leftarrow CO]}
(4)氯化: \ce{B2H6 + 6Cl2\rightarrow 2BCl3 + 6HCl}
2.硼的含氧化合物
1.三氧化二硼 \ce{B2O3} :是原子晶体,熔点450 ^\circ C ,无定形体:软化
加水生成硼酸,加Mg/Al形成B(无定形)单质
2.硼酸 \ce{H3BO3} : sp^2 杂化,有氢键。是二维平面结构,与石墨有相似性,(润滑,解离等)
是一元弱酸,水解与Al相似;易于多羟基化合物加合;受热易分解(先得到偏硼酸,再得到三氧化二硼)

3. 硼砂 \ce{Na2B4O7·10H2O} (准确写法: \ce{NaB4O5(OH)4·8H2O} )
[硼砂的主要几个反应除脱水外,都需要水参与反应]

\star 硼砂水解显碱性: \ce{[B4O5(OH)4]^2- + 5H2O\Leftrightarrow}4\ce{H3BO3 + 2OH-}\Leftrightarrow 2\ce{H3BO3 + 2B(OH)4^-} (这对缓冲溶液的pH为9.24,20℃)
与酸反应制取硼酸: \ce{Na2B4O7 +H2SO4 +5H2O \rightarrow 4H3BO3 + Na2SO4}
硼砂脱水:
\ce{Na2B4O7·10H2O \rightarrow B2O3 +2NaBO2 +10H2O} (878℃)(偏硼酸钠)
硼砂珠实验鉴别物质

硼的卤化物

硼的卤化物水解生成硼酸和氢卤酸(除 \ce{BF3} 外) \ce{4BF3 + 3H2O \rightarrow H3BO3 +3H[BF4]} \ \ \ (\ce{BF3 +HF \rightarrow H[BF4]}) ( 因为氟原子特别小)
硼的氮化物
BN与 \ce{C2} 是等电子体。BN有三种晶型:无定形(类似于无定形碳),六方晶型(类似于石墨),立方晶型(类似于金刚石)
无机苯(硼氮苯)——电子结构和几何形状与苯都相似。

2.4.铝的化合物
1.氧化铝&氢氧化铝
α晶型的氧化铝:刚玉,硬度大,不溶于水,酸,碱。
γ晶型的氧化铝:是活性氧化铝,可溶于酸碱,可以作为催化剂载体。
含有一些杂质金属离子的氧化铝会出现鲜明的颜色,就会变成各种各样的宝石。
氢氧化铝是一种两性氢氧化物……具体就略了哈^-^啊提一下: 氯化铝遇氨气生成氯化铵(白烟),因而要用干法合成氯化铝。

(啊呀,咋就更不下去了捏?老了。。脑阔疼。)
我又回来了!~接上!
2.铝的卤化物:除氟化铝是离子晶体之外其他都是分子晶体(熔点低,易挥发,易溶于有机溶剂,易形成双聚物)
铝的卤化物水解生成氢氧化铝和氢卤酸。
3.铝的含氧酸盐
硫酸铝: \ce{Al2(SO4)3·18H2O}
铝钾矾(明矾)(含多种阳离子的是复盐): \ce{KAl(SO4)2·12H2O}
\ce{Al^3+} 容易发生双水解。 鉴定方法: 再氨碱性条件下加入茜素生成红色絮状螯合物反应方程式等具体见我之前的文章。
3.碳族元素
3.1.碳族元素的概述
3.2.碳族元素的单质
碳单质的同素异形体主要有金刚石:原子晶体,硬度最大,熔点最高( \ce{sp^3} )。石墨:层状混合晶体(同层是 \ce{sp^2} 杂化)具有非常好的导电性,把石墨一层一层接下来形成的物质就叫石墨烯,把单层石墨“卷起来”就变成了碳纳米管,碳纳米管硬度极高,在极低温度下还具有超导性,“卷”的螺旋性不同,纳米管的导电性就不同。富勒烯:球形结构, \ce{C60或C70} ( \ce{sp^2} 杂化)。
硅单质有无定形和晶体两种,其晶体类型类似于金刚石。
锗单质是灰白色金属,硬而脆,结构类似于金刚石。
锡单质有三种同素异形体:
铅单质:质软,能阻挡x射线。可作电缆的包皮,核反应堆的防护屏。
3.3.碳的化合物
1.碳的氧化物
(1)一氧化碳(CO)结构:一个 \sigma 键,两个 \pi 键,于 \ce{N2} 是等电子体。
一氧化碳分子轨道相当复杂,因而电子云更偏向C这边。
性质:(1)作配位体,形成羰基配合物——其中C是配位原子;(2)作还原剂;【和金属氧化物或氧气反应】(3)剧毒
(2)二氧化碳——直线形结构【含两个三中心四电子的大Π键】C是sp杂化
丙酮中测得的C=O双键的键长为124pm,叁键键长为113pm
2.碳酸及其盐
二氧化碳溶于水大部分为 \ce{CO2·H2O} 极小部分为碳酸
\ce{CO3^2- 与BF3} 为等电子体。其中C为 \ce{sp^2} 杂化
碳酸盐及其稳定性:
(1) \ce{H2CO3< MHCO3<M2CO3}
(2)同一族金属的碳酸盐稳定性从上到下增加。
(3)过渡金属碳酸盐稳定性差
离子极化观点:(阳离子半径越小,)阳离子极化力越大,其碳酸盐越不稳定。
碳酸盐的溶解度:除Na盐K盐外,其他碳酸盐均难溶。(碳酸氢盐分子间氢键,可形成二聚物或多聚物)。
可溶性碳酸盐与金属离子作用的产物类型:
水溶液中存在碳酸盐的水解:显强碱性,有碳酸盐,也有碳酸氢盐
金属离子加入可溶性碳酸盐时,生成沉淀类型:
- 氢氧化物碱性比较强的金属离子与之反应生成碳酸盐沉淀。如钡、锶、钙、银(离子)等。
- 氢氧化物碱性较弱的金属离子与之反应后生成碳酸羟盐(碱式碳酸盐)沉淀。如:铅、铋、铜、锌、镁、镍等。
- 水解性强、两性的金属离子与之反应生成氢氧化物沉淀和二氧化碳。(双水解)如:铝、铁、铬等。
3.4.硅的化合物
1.硅的氧化物
无定形体:石英玻璃、硅藻土、燧石
晶 体:天然晶体为石英,属于原子晶体(纯石英:水晶;含有杂质的石英:玛瑙,紫晶)
二氧化硅:硅氧四面体
性质:
(1)与碱(或碱性盐)作用:生成硅酸盐
(2)与HF作用
\ce{SiO2 + 4HF \rightarrow SiF4 + 2H2O}
2.硅酸及其盐

硅酸的制备: \ce{Na2SiO3 + 2HCl \rightarrow H2SiO3 +2NaCl}
或 \ce{Na2SiO3 + 2NH4Cl \rightarrow H2SiO3 + 2NaCl +2 NH3}
胶冻状硅酸脱水后形成硅胶;浸透过氯化钴的硅胶为变色硅胶。

玻璃的主要原料:碳酸钠,碳酸钙,二氧化硅;水泥:氧化钙与硅铝酸盐混合物。
3.沸石分子筛:骨架由顶角相连的 \ce{SiO4和AlO4} 四面体组成。

阴离子骨架中Si/Al比是影响沸石结构和性质的重要参数,分子筛的耐酸能力和热稳定性随此增大而升高。
具有的功能:

4.硅的卤化物
水解生成硅酸和卤化氢。金刚砂:SiC
3.5.锡、铅的化合物
\star 1.氧化物和氢氧化物 (好像无机化学元素这一块,从这里开始,之后就开始东西多了^^)

β型锡酸既不溶于酸又不溶于碱
Sn(Ⅱ)的还原性
(1)Sn与Hg的相互鉴定
\ce{Sn^2+ + 2HgCl2 +4Cl^- \rightarrow Hg2Cl2 (s,白) + SnCl6^2-}
\ce{Sn^2+ +Hg2Cl2 +4Cl- \rightarrow 2Hg(l,黑) +SnCl6^2-}
(2)其他重要还原方程式
\ce{Sn^2+ + 2Fe^3+ \rightarrow Sn^4+ +2Fe^2+}
\ce{Bi(OH)3+3[Sn(OH)4]^2- \rightarrow 2Bi(s,黑) +3[Sn(OH)6]^2-} (鉴定Bi离子)
Pb(Ⅳ)的氧化性

二氧化铅与硫酸反应自身发生歧化,生成氧气。
2.锡、铅的盐

Pb(Ⅱ)的鉴定:
\ce{Pb^2+ +CrO4^2- \rightarrow PbCrO4(s,黄色)} // \ce{PbCrO4} 溶于过量的碱,与黄色 \ce{BaCrO4} 有别。
3.锡、铅的硫化物
SnS(棕)、SnS2(黄)、PbS(黑)
均不溶于稀盐酸
配位溶解(浓HCl)
\ce{SnS +4HCl \rightarrow H2SnCl4 + H2S}
\ce{PbS +4HCl\rightarrow H2PbCl4 +H2S}
\ce{SnS2 +6HCl \rightarrow HaSnCl6 +2H2S}



呀哈,更完了^3^//~
